Indlægsseddel
Veterinærlægemidlets navn
Vetmedin®
vet. 1,5 mg/ml oral opløsning til hund
Se den nyeste indlægsseddel på www.indlaegsseddel.dk
Sammensætning
Hver ml indeholder:
Aktivt stof:
Pimobendan: 1,5 mg
Hjælpestoffer:
Sorbinsyre (E200): 3,0 mg
Ascorbinsyre (E300): 7,0 mg
Klar, farveløs til gul til let grøn til let brun opløsning.
Dyrearter
Hund
Indikationer
Behandling af hjertesvigt hos hund forårsaget af dilateret kardiomyopati (hjertemuskelsygdom) eller valvulær insufficiens (hjerteklapsygdom omfattende utæthed af mitral og/eller trikuspidalklappen).
Behandling af dilateret kardiomyopati i stadiet før der ses kliniske tegn på sygdommen (asymptomatisk med en forøgelse af venstre ventrikels slut-systoliske og slut-diastoliske diameter) hos dobermann pinscher efter diagnosticering af hjertesygdom med ultralyd.
Kontraindikationer
Pimobendan må ikke anvendes ved hypertrofisk kardiomyopati (hjertemuskelsygdom) eller kliniske tilstande, hvor en forøgelse af minutvolumen umuliggøres af funktionelle eller anatomiske årsager (f.eks. aorta stenose, en forsnævring i aortaklappen).
Må ikke anvendes i tilfælde af svært nedsat leverfunktion, da pimobendan hovedsageligt metaboliseres via leveren.
Må ikke anvendes i tilfælde af overfølsomhed over for det aktive stof, eller over for et eller flere af hjælpestofferne.
Særlige advarsler
Veterinærlægemidlet er ikke testet i tilfælde af asymptomatisk (uden kliniske tegn på sygdom) dilateret kardiomyopati (hjertemuskelsygdom) hos dobermann med atrieflimmer (forkammerflimmer) eller vedvarende ventrikulær takykardi (hjerterytmeforstyrrelser fra hjertekamrene).
Særlige forholdsregler vedrørende sikker anvendelse hos den dyreart, som lægemidlet er beregnet til:
Blodsukker skal kontrolleres regelmæssigt under behandling
med pimobendan hos hunde med diagnosticeret sukkersyge.
Ved behandling af dilateret kardiomyopati (hjertemuskelsygdom) i stadiet før der ses kliniske tegn på sygdommen (asymptomatisk med en forøgelse af venstre ventrikels slut-systoliske og slut-diastoliske diameter), skal diagnosen baseres på en omfattende hjerteundersøgelse (inkl. ultralydsundersøgelse af hjertet og evt. Holterovervågning).
Det anbefales at hjertefunktion og -morfologi overvåges hos dyr, der behandles med pimobendan.
Særlige forholdsregler for personer, der administrerer lægemidlet til dyr:
Ved overfølsomhed over for pimobendan eller over for nogle
af hjælpestofferne bør kontakt med veterinærlægemidlet
undgås.
Dette veterinærlægemiddel kan forårsage hud- og øjenirritation. Undgå kontakt med hud og øjne. I tilfælde af kontakt med øjnene eller spild på huden skylles straks grundigt med vand. Vask hænder efter brug.
Utilsigtet indtagelse, især hos børn, kan medføre takykardi (øget hjertefrekvens), ortostatisk hypotension (pludseligt lavt blodtryk, når man rejser sig op efter at have siddet eller ligget ned), ansigtsrødmen og hovedpine.
For at undgå utilsigtet indtagelse, bør en fyldt sprøjte ikke efterlades uden opsyn og flasken og den brugte sprøjte bør opbevares i den originale æske for at forhindre børn i at få adgang til veterinærlægemidlet.
Luk flasken stramt til med låget umiddelbart efter, at den ønskede mængde opløsning er fjernet.
Veterinærlægemidlet skal bruges og opbevares utilgængeligt for børn.
I tilfælde af utilsigtet indtagelse skal der straks søges lægehjælp, og indlægssedlen eller etiketten bør vises til lægen.
Drægtighed og diegivning:
Veterinærlægemidlets sikkerhed under drægtighed og
diegivning er ikke fastlagt hos tæver. Må kun anvendes i
overensstemmelse med den ansvarlige dyrlæges vurdering af
benefit/risk-forholdet.
Laboratorieundersøgelser af rotter og kaniner har ikke afsløret fosterskadelige virkninger. Imidlertid har disse undersøgelser vist tegn på skadelige virkninger på moderdyr og embryon ved høje doser. Derudover har undersøgelserne vist, at pimobendan udskilles i mælken.
Interaktion med andre lægemidler og andre former for interaktion:
I farmakologiske studier sås ingen interaktion
mellem hjerteglycosidet ouabain (strofantin) og
pimobendan. Den pimobendaninducerede forbedring
af hjertets kontraktionsevne svækkes ved brug af
calciumantagonisterne verapamil og diltiazem og af
β-antagonisten propranolol.
Overdosis:
Overdosering kan medføre en positiv kronotrop
virkning (øget hjertefrekvens), opkastning, apati, ataksi
(inkoordination), hjertemislyde eller hypotension
(blodtryksfald).
I dette er tilfælde, skal dosis reduceres og en passende symptomatisk behandling iværksættes. Ved langvarig eksponering (6 måneder) hos raske beaglehunde med 3 til 5 gange den anbefalede dosis, blev fortykkelse af mitralklappen og venstresidig ventrikelhypertrofi observeret hos nogle hunde. Disse forandringer er af farmakodynamisk oprindelse.
Væsentlige uforligeligheder:
Da der ikke er undersøgelser vedrørende eventuelle
uforligeligheder, må dette veterinærlægemiddel ikke blandes
med andre veterinærlægemidler.
Bivirkninger
Hund:
Sjælden (1 til 10 dyr ud af 10.000 behandlede dyr):
- Opkastning1, diarré2
- Nedsat ædelyst2, sløvhed2
- Øget hjertefrekvens1,3
- Øget mitral regurgitation (tilbagestrømning af blod over
mitralklappen)4
Meget sjælden (< 1 dyr ud af 10.000 behandlede dyr,
herunder enkeltstående indberetninger):
- Petekkier (små røde prikker) på slimhinder5, subkutan
blødning5
1 Denne virkning er dosisafhængig og kan undgås ved at reducere dosis.
2 Forbigående.
3 Forårsaget af en let positiv kronotrop virkning.
4 Observeret under kronisk pimobendanbehandling hos hunde med mitralklapsygdom.
5 Sammenhæng med pimobendan er ikke klart fastslået, tegnene forsvinder når behandlingen afbrydes.
Indberetning af bivirkninger er vigtigt, da det muliggør løbende sikkerhedsovervågning af et produkt. Kontakt i første omgang din dyrlæge, hvis du observerer bivirkninger. Dette gælder også bivirkninger, der ikke allerede er anført i denne indlægsseddel, eller hvis du mener, at medicinen ikke har virket.
Du kan også indberette bivirkninger til indehaveren af
markedsføringstilladelsen eller den lokale repræsentant ved
hjælp af kontaktoplysningerne sidst i denne indlægsseddel
eller via det nationale bivirkningssystem:
Lægemiddelstyrelsen
Axel Heides Gade 1
DK-2300 København S
www.meldenbivirkning.dk
Dosering for hver dyreart, administrationsveje og administrationsmåde
Oral anvendelse.
Ryst ikke flasken før eller under brug for at undgå skumdannelse.
For at sikre korrekt dosering bør legemsvægten bestemmes så nøjagtigt som muligt.
Dosering inden for intervallet 0,2 mg til 0,6 mg pimobendan/kg legemsvægt, fordelt på to daglige doser, bør overholdes. Den foretrukne daglige dosering er 0,5 mg pimobendan/kg legemsvægt, fordelt på to daglige doser, med ca. 12 timers mellemrum (dvs. 0,25 mg pimobendan/kg legemsvægt svarende til 0,17 ml af veterinærlægemidlet to gange dagligt).
Opløsningen skal administreres ved hjælp af doseringssprøjten, der medfølger i pakningen. Sprøjten er forsynet med en skala for legemsvægt i kg med trin på 0,5 kg op til en legemsvægt på 12 kg og passer på flasken. Hvert trin på 1 kg svarer til 0,25 mg pimonbendan.
Dyrets samlede legemsvægt bør anvendes ved hver administration.
For eksempel skal veterinærlægemidlet til en hund på 6 kg trækkes op til 6 kg-mærket på sprøjten ved hver administration (dette svarer til en dosis på 0,25 mg pimobendan/kg legemsvægt pr. administration). Overskrid ikke den anbefalede dosis.
Hver dosis skal administreres direkte i munden, på tom mave ca. 1 time før fodring. Efter administration lukkes flasken stramt til med låget. Rengør sprøjtens yderside med en ren, tør klud eller serviet efter hver brug. Den brugte serviet skal straks smides ud.
Hvis sprøjten tilstopper, skylles sprøjten med vand uden at fjerne stemplet, og sprøjtens yderside tørres af med en ren klud eller serviet. For at undgå kontaminering må den medfølgende sprøjte kun anvendes til administration af denne orale opløsning. Den brugte sprøjte skal opbevares sammen med veterinærlægemidlet i den originale æske.
Pimobendan kan også anvendes i kombination med et diuretikum, f.eks. furosemid.
Vær opmærksom på, at dyrlægen kan have foreskrevet anden anvendelse eller dosering end angivet i denne information. Følg altid dyrlægens anvisning og oplysningerne på doseringsetiketten.
Oplysninger om korrekt administration
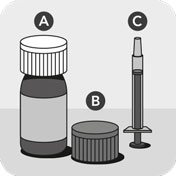
Veterinærlægemidlet består af en flaske forseglet med et børnesikret låg A, et ekstra børnesikret låg med integreret plugin-adapter B og en doseringssprøjte forsynet med en skala for legemsvægt i kg C.
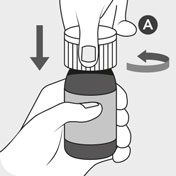
Ryst ikke flasken før brug (dette forhindrer skumdannelse). Flasken holdes lodret og åbnes ved at trykke det børnesikrede låg ned A og samtidig dreje låget mod uret. Kassér det hvide låg A.
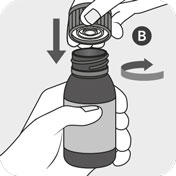
Luk flasken stramt til med låget B og drej samtidig låget med uret. Låget B indeholder en integreret plugin-adapter, som automatisk sættes fast i flasken A. Sørg for, at låget er skruet stramt på, for at sikre at adapteren indsættes rigtigt.
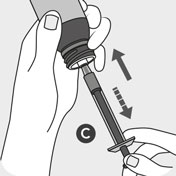
Fjern låget B fra flasken ved at trykke det børnesikrede
låg ned og drej samtidig låget mod uret. Sæt forsigtigt
doseringssprøjtens spids C fast på flaskeadapteren.
Vend flasken og sprøjten med bunden i vejret.
Træk stemplet ud og fyld doseringssprøjten til den dosis,
som dyrlægen har ordineret.
Vend flasken lodret og fjern doseringssprøjten fra flasken.
Luk flasken med låget B.
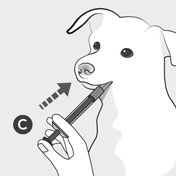
Kom spidsen af doseringssprøjten C i hundens mund og tryk stemplet i bund for at give den ordinerede dosis.
Informationen er også tilgængelig via dette link: info.vetmedin.com/eu

Tilbageholdelsestid(er)
Ikke relevant.
Særlige forholdsregler vedrørende opbevaring
Opbevares utilgængeligt for børn.
Opbevares under 30 °C.
Opbevaringstid efter første åbning af den indre emballage:
8 uger.
Brug ikke dette veterinærlægemiddel efter den udløbsdato,
der står på æsken og flasken efter Exp. Udløbsdatoen er den
sidste dag i den pågældende måned.
Særlige forholdsregler vedrørende bortskaffelse
Lægemidler må ikke bortskaffes sammen med spildevand
eller husholdningsaffald.
Benyt returordninger ved bortskaffelse af ubrugte
veterinærlægemidler eller relateret affald i henhold
til lokale retningslinjer samt eventuelle nationale
indsamlingsordninger, der er relevante for det pågældende
veterinærlægemiddel. Disse foranstaltninger skal bidrage til
at beskytte miljøet.
Kontakt dyrlægen eller apotekspersonalet vedrørende
bortskaffelse af overskydende lægemidler.
Klassificering af veterinærlægemidler
Veterinærlægemidlet udleveres kun på recept.
Markedsføringstilladelsesnumre og pakningsstørrelser
MTnr: 71983
Kartonæske med 1 flaske fyldt med 50 ml og 1 doseringssprøjte forsynet med en skala for legemsvægt i kg med trin på 0,5 kg.
Dato for seneste ændring af indlægssedlen
04/2025
Der findes detaljerede oplysninger om dette veterinærlægemiddel i EU-lægemiddeldatabasen (https://medicines.health.europa.eu/veterinary).
Kontaktoplysninger
Indehaver af markedsføringstilladelsen og fremstiller ansvarlig for batchfrigivelse:
Boehringer Ingelheim Vetmedica GmbH
55216 Ingelheim/Rhein
Tyskland
Lokale repræsentanter og kontaktoplysninger til indberetning af formodede bivirkninger:
Boehringer Ingelheim Animal Health Nordics A/S
Weidekampsgade 14
2300 København S
Tlf: +45 3915 8888
