Příbalový leták
Název veterinárního léčivého přípravku
Vetmedin®
1,5 mg/ml perorální roztok pro psy
Složení
Každý ml obsahuje:
Léčivá látka:
Pimobendanum: 1,5 mg
Pomocné látky:
Kyselina sorbová (E200): 3,0 mg
Kyselina askorbová (E300): 7,0 mg
Čirý, bezbarvý až žlutý až slabě zelený až slabě hnědý roztok.
Cílové druhy zvířat
Psi
Indikace pro použití
Léčba městnavého srdečního selhání u psů vyvolaného dilatační kardiomyopatií (DCM) nebo nedostatečností srdečních chlopní (nedomykavost mitrální a/nebo trikuspidální chlopně).
Léčba dilatační kardiomyopatie v preklinickém stádiu (asymptomatická s nárůstem konečného systolického a konečného diastolického rozměru levé komory) u dobrmanů po echokardiografické diagnóze onemocnění srdce.
Kontraindikace
Nepoužívat pimobendan v případech hypertrofických
kardiomyopatií nebo v případě takových onemocnění,
kdy zlepšení srdečního výdeje nemůže být z funkčních
nebo anatomických důvodů dosaženo (např. stenóza
aorty).
Nepoužívat v případech vážného poškození jaterních
funkcí, protože pimobendan je metabolizován zejména
játry.
Nepoužívat v případech přecitlivělosti na léčivou látku
nebo na některou z pomocných látek.
Zvláštní upozornění
Veterinární léčivý přípravek nebyl testován v případech asymptomatické dilatační kardiomyopatie DCM u dobrmanů s fibrilací síní nebo trvalou komorovou tachykardií.
Zvláštní opatření pro použití u cílových druhů zvířat:
U psů s prokázaným diabetes mellitus má být v
průběhu léčby pimobendanem pravidelně testována
hladina glukózy v krvi. Před použitím v preklinickém
stadiu dilatační kardiomyopatie (asymptomatická,
s nárůstem konečného systolického a konečného
diastolického rozměru levé komory) by měla být
stanovena diagnóza na základě komplexního vyšetření
srdce (vč. echokardiografického vyšetření, příp.
vyšetření metodou Holter).
U zvířat léčených pimobendanem se doporučuje pravidelný monitoring srdečních funkcí a morfologie srdce (viz bod „Nežádoucí účinky“).
Zvláštní opatření pro osobu, která podává veterinární léčivý přípravek zvířatům:
Lidé se známou přecitlivělostí na pimobendan nebo
jakoukoli z pomocných látek by se měli vyhnout
kontaktu s veterinárním léčivým přípravkem.
Tento veterinární léčivý přípravek může způsobit podráždění pokožky a očí. Vyhněte se kontaktu s pokožkou a očima. V případě zasažení očí nebo potřísnění kůže, ihned důkladně vypláchněte vodou. Po použití si umyjte ruce.
Náhodné požití, zejména dítětem, může vést k výskytu
tachykardie, ortostatické hypotenze, zrudnutí obličeje
a bolestem hlavy.
Aby nedošlo k náhodnému požití, nenechávejte
naplněnou injekční stříkačku bez dozoru
a uchovávejte lahvičku a použitou injekční stříkačku
v původním obalu, aby se zabránilo dětem v přístupu
k veterinárnímu léčivému přípravku.
Lahvičku pevně uzavřete víčkem ihned po vyjmutí
požadovaného množství roztoku.
Veterinární léčivý přípravek musí být používán
a uchováván mimo dohled a dosah dětí.
V případě náhodného požití vyhledejte ihned lékařskou
pomoc a ukažte příbalovou informaci nebo etiketu
praktickému lékaři.
Březost a laktace:
Nebyla stanovena bezpečnost veterinárního léčivého
přípravku pro použití během březosti a laktace u fen.
Použít pouze po zvážení terapeutického prospěchu a rizika příslušným veterinárním lékařem. Laboratorní studie u potkanů a králíků nepodaly důkaz o teratogenním ani fetotoxickém účinku. Nicméně při vysokých dávkách tyto studie prokázaly maternální toxicitu a embryotoxické účinky a zároveň bylo prokázáno, že pimobendan je vylučován do mléka.
Interakce s jinými léčivými přípravky a další formy interakce:
Farmakologickými studiemi nebyla prokázána interakce
mezi srdečním glykosidem ouabainem (strophanthin)
a pimobendanem. Zvýšená kontraktilita srdečního svalu
navozená pimobendanem je zeslabována v přítomnosti
antagonistů kalcia verapamilu a diltiazemu
a β-blokátoru propranololu.
Předávkování:
Předávkování může způsobit pozitivně chronotropní
účinek, zvracení, apatii, ataxii, srdeční šelesty nebo
hypotenzi. V takovém případě je třeba snížit dávku,
a zahájit vhodnou symptomatickou léčbu.
Při prodloužené expozici (6 měsíců) zdravých bíglů
dávce odpovídající 3 až 5násobku doporučené dávky
byly u některých psů pozorovány ztluštění mitrální
chlopně a hypertrofie levé komory. Jedná se o změny
farmakodynamického původu.
Hlavní inkompatibility:
Studie kompatibility nejsou k dispozici, a proto tento
veterinární léčivý přípravek nesmí být mísen s žádnými
dalšími veterinárními léčivými přípravky.
Nežádoucí účinky
Psi:
Vzácné (1 až 10 zvířat / 10 000 ošetřených zvířat):
- Zvracení1, průjem2
- Anorexie2, letargie2
- Zvýšená srdeční frekvence1,3
- Zvýšení regurgitace mitrální chlopně4
Velmi vzácné (< 1 zvíře / 10 000 ošetřených zvířat,
včetně ojedinělých hlášení):
- Slizniční petechie5, krvácení (podkožní)5
1. Tyto účinky jsou závislé na dávce a lze se jim vyhnout snížením dávky.
2. Přechodné.
3. Díky slabě pozitivnímu chronotropnímu účinku.
4. Pozorovány při dlouhodobé léčbě pimobendanem u psů s onemocněním mitrální chlopně.
5. Souvislost s pimobendanem nebyla jasně stanovena, příznaky mizí po vysazení léčby.
Hlášení nežádoucích účinků je důležité. Umožňuje nepřetržité sledování bezpečnosti přípravku. Jestliže zaznamenáte jakékoliv nežádoucí účinky, a to i takové, které nejsou uvedeny v této příbalové informaci, nebo si myslíte, že léčivo nefunguje, obraťte se prosím nejprve na svého veterinárního lékaře. Nežádoucí účinky můžete hlásit také držiteli rozhodnutí o registraci nebo jeho místnímu zástupci s využitím kontaktních údajů uvedených na konci této příbalové informace nebo prostřednictvím národního systému hlášení nežádoucích účinků:
Ústav pro státní kontrolu veterinárních biopreparátů
a léčiv
Hudcova 232/56a
621 00 Brno
adr@uskvbl.cz
http://www.uskvbl.cz/cs/farmakovigilance
Dávkování pro každý druh, cesty a způsob podání
Perorální podání.
Neprotřepávat lahvičku před ani během použití, aby nedošlo k tvorbě pěny.
Pro zajištění správného dávkování je třeba co nejpřesněji stanovit živou hmotnost.
Dávka se podává v rozmezí 0,2 mg až 0,6 mg pimobendanu/kg ž.hm. podávaných rozděleně ve dvou denních dávkách. Preferovaná denní dávka je 0,5 mg pimobendanu/kg ž.hm. podávaná rozděleně ve dvou denních dávkách s odstupem přibližně 12 hodin. (tj., 0,25 mg pimobendanu/kg ž. hm. odpovídá 0,17 ml veterinárního léčivého přípravku dvakrát denně).
Roztok by měl být podán pomocí odměrné stříkačky, která je součástí balení. Odměrná stříkačka má stupnici podle kg živé hmotnosti s dílky po 0,5 kg až do 12 kg živé hmotnosti a je kompatibilní s lahvičkou. Každý 1 kg dílek stupnice odpovídá 0,25 mg pimobendanu. Při každém podání by měla být použita celková živá hmotnost zvířete. Například u psa o hmotnosti 6 kg by měl být veterinární léčivý přípravek při každém podání natažen po značku 6 kg na odměrné stříkačce (to odpovídá dávce 0,25 mg pimobendanu/kg živé hmotnosti na podání). Nepřekračujte doporučené dávkování.
Každá dávka by měla být podána přímo do tlamy na
lačno, přibližně jednu hodinu před krmením. Po podání
lahvičku pevně uzavřete uzávěrem. Po každém použití
očistěte vnější část odměrné stříkačky čistým suchým
hadříkem nebo ubrouskem. Kontaminovaný ubrousek
musí být ihned zlikvidován.
Pokud se odměrná stříkačka ucpe, opláchněte ji bez
vyjmutí pístu vodou a vnější část stříkačky otřete do
sucha čistým hadříkem nebo ubrouskem. Abyste
předešli kontaminaci, používejte přiloženou odměrnou
stříkačku pouze k podání tohoto perorálního roztoku.
Použitou odměrnou stříkačku uchovávejte společně
s přípravkem v původním obalu.
Pimobendan lze použít také v kombinaci s diuretiky, např. furosemidem.
Informace o správném podávání
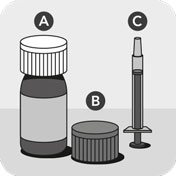
Veterinární léčivý přípravek se skládá z lahvičky uzavřené dětským bezpečnostním uzávěrem A, druhého dětského bezpečnostního uzávěru s integrovaným zásuvným adaptérem B a odměrné stříkačky se stupnicí v kg živé hmotnosti C.
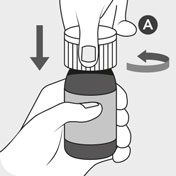
Neprotřepávejte lahvičku před použitím (zabráníte tak
tvorbě pěny).
Otevřete lahvičku ve svislé poloze stlačením dětského
bezpečnostního uzávěru A a současným otáčením uzávěru
proti směru hodinových ručiček. Bílý uzávěr A zlikvidujte.
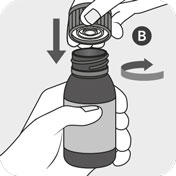
Lahvičku pevně uzavřete uzávěrem B a současně otáčejte uzávěrem ve směru hodinových ručiček. Uzávěr B obsahuje integrovaný zásuvný adaptér, který by se měl automaticky připojit k lahvičce A. Ujistěte se, že je uzávěr pevně uzavřen, aby bylo možné správně zasunout adaptér.
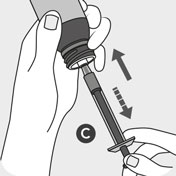
Sejměte uzávěr B z lahvičky současným stlačením
a otáčením dětského bezpečnostního uzávěru proti směru
hodinových ručiček a jemně zatlačte na konec odměrné
stříkačky C na uzávěru lahvičky.
Otočte lahvičku a odměrnou stříkačku dnem vzhůru.
Zatáhněte za píst a naplňte odměrnou stříkačku po dávku
předepsanou veterinárním lékařem.
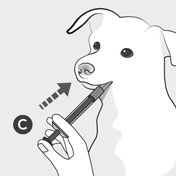
Otočte lahvičku do svislé polohy a vyjměte odměrnou stříkačku z lahvičky. Uzavřete lahvičku uzávěrem B. Vložte konec odměrné stříkačky C do tlamy vašeho psa a zatlačte na píst pro podání předepsané dávky.
Informace jsou dostupné také pod tímto odkazem:
info.vetmedin.com/eu

Ochranné lhůty
Neuplatňuje se.
Zvláštní opatření pro uchovávání
Uchovávejte mimo dohled a dosah dětí.
Uchovávejte při teplotě do 30 °C.
Doba použitelnosti po prvním otevření vnitřního obalu:
8 týdnů.
Nepoužívejte tento veterinární léčivý přípravek po
uplynutí doby použitelnosti uvedené na krabičce
a lahvičce po Exp. Doba použitelnosti končí posledním
dnem v uvedeném měsíci.
Zvláštní opatření pro likvidaci
Léčivé přípravky se nesmí likvidovat prostřednictvím
odpadní vody či domovního odpadu.
Všechen nepoužitý veterinární léčivý přípravek nebo
odpad, který pochází z tohoto přípravku, likvidujte
odevzdáním v souladu s místními požadavky a platnými
národními systémy sběru. Tato opatření napomáhají
chránit životní prostředí.
O možnostech likvidace nepotřebných léčivých
přípravků se poraďte s vaším veterinárním lékařem
nebo lékárníkem.
Klasifikace veterinárních léčivých přípravků
Veterinární léčivý přípravek je vydáván pouze na předpis.
Registrační čísla a velikosti balení
96/021/25-C
Papírová krabička s 1 lahvičkou s 50 ml a 1 odměrnou stříkačkou se stupnicí podle kg živé hmotnosti s dílky po 0,5 kg.
Datum poslední revize příbalové informace
06/2025
Podrobné informace o tomto veterinárním léčivém přípravku jsou k dispozici v databázi přípravků Unie (https://medicines.health.europa.eu/veterinary).
Podrobné informace o tomto veterinárním léčivém přípravku naleznete také v národní databázi (https://www.uskvbl.cz).
Kontaktní údaje
Držitel rozhodnutí o registraci a výrobce odpovědný za uvolnění šarže:
Boehringer Ingelheim Vetmedica GmbH
55216 Ingelheim/Rhein
Německo
Místní zástupci a kontaktní údaje pro hlášení podezření na nežádoucí účinky:
Boehringer Ingelheim spol. s.r.o.
Tel: +420 234 655 111
