Packungsbeilage
Bezeichnung des Tierarzneimittels
Vetmedin®
1,5 mg/ml Lösung zum Eingeben für Hunde
Zusammensetzung
Jeder ml enthält:
Wirkstoff:
Pimobendan: 1,5 mg
Sonstige Bestandteile:
Sorbinsäure (E200): 3,0 mg
Ascorbinsäure (E300): 7,0 mg
Klare, farblose bis gelbe, bis grünliche, bis bräunliche Lösung.
Zieltierart(en)
Hund
Anwendungsgebiete
Zur Behandlung der kongestiven Herzinsuffizienz beim Hund, hervorgerufen durch eine dilatative Kardiomyopathie (DCM) oder durch Klappeninsuffizienz (Mitralklappen- und/oder Trikuspidalklappen-Regurgitation).
Zur Behandlung der dilatativen Kardiomyopathie im präklinischen Stadium (asymptomatisch mit Zunahme des linksventrikulären endsystolischen und enddiastolischen Durchmessers) bei Dobermann-Pinschern nach echokardiographischer Abklärung der Herzerkrankung.
Zur Behandlung von Hunden mit Mitralklappenendokardiose (MMVD) in der präklinischen Phase (asymptomatisch mit einem systolischen Herzgeräusch und nachweislich vergrößertem Herzen), um das Auftreten klinischer Symptome der Herzinsuffizienz zu verzögern.
Gegenanzeigen
Pimobendan nicht anwenden bei hypertrophen Kardiomyopathien oder bei Erkrankungen, bei denen eine Verbesserung des Herzauswurfvolumens aus funktionellen oder anatomischen Gründen nicht erzielt werden kann (z. B. Aortenstenose).
Nicht anwenden bei schwerer Beeinträchtigung der Leberfunktion, da Pimobendan überwiegend über die Leber metabolisiert wird.
Nicht anwenden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
Besondere Warnhinweise
Das Tierarzneimittel wurde nicht bei asymptomatischer dilatativer Kardiomyopathie (DCM) an Dobermann-Hunden mit Vorhofflimmern oder anhaltender ventrikulärer Tachykardie untersucht.
Das Tierarzneimittel wurde nicht an Hunden mit asymptomatischer Mitralklappenendokardiose und ausgeprägter supraventrikulärer und/oder ventrikulärer Tachyarrhythmie erprobt.
Besondere Vorsichtsmaßnahmen für die sichere Anwendung bei den Zieltierarten:
Bei Hunden mit bestehendem Diabetes mellitus sollte während der Behandlung mit Pimobendan eine regelmäßige Blutzuckerkontrolle durchgeführt werden.
Für die Anwendung im präklinischen Stadium der dilatativen Kardiomyopathie (asymptomatisch mit Zunahme des linksventrikulären endsystolischen und enddiastolischen Durchmessers) sollte eine Diagnosestellung mittels einer umfassenden Herzuntersuchung (inkl. echokardiographischer Untersuchung und evtl. Holter-Monitoring) erfolgen.
Bei Anwendung in der präklinischen Phase der Mitralklappenendokardiose (Stadium B2, nach ACVIM Konsensus: asymptomatisch mit Herzgeräusch ≥ 3/6 und Kardiomegalie durch MMVD), sollte die Diagnose anhand einer umfassenden klinischen und kardialen Untersuchung gestellt werden, gegebenenfalls einschließlich Echokardiographie oder Röntgenuntersuchung.
Bei mit Pimobendan behandelten Tieren sollten regelmäßige Kontrollen der Herzfunktion und Herzmorphologie durchgeführt werden.
Besondere Vorsichtsmaßnahmen für den Anwender:
Personen mit bekannter Überempfindlichkeit gegen Pimobendan oder einem anderen Bestandteil sollten den Kontakt mit dem Tierarzneimittel vermeiden.
Dieses Tierarzneimittel kann Haut- und Augenreizungen verursachen. Kontakt mit Haut und Augen vermeiden. Bei versehentlichem Kontakt mit den Augen oder Hautexposition sofort gründlich mit Wasser spülen. Nach der Anwendung Hände waschen.
Eine versehentliche Einnahme kann insbesondere bei Kindern zum Auftreten von Tachykardie (Herzrasen), orthostatischer Hypotonie (Blutdruckabfall beim Aufstehen), anfallsartiger Gesichtsrötung und Kopfschmerzen führen.
Um eine versehentliche Einnahme zu verhindern, lassen Sie die gefüllte Spritze nicht unbeaufsichtigt liegen und bewahren Sie Flasche und gebrauchte Spritze in der Originalverpackung auf, so dass Kinder keinen Zugang zu dem Tierarzneimittel haben.
Die Flasche ist nach der Entnahme der benötigten Menge an Lösung sofort fest zu verschließen.
Das Tierarzneimittel muss außerhalb der Sicht- und Reichweite von Kindern verwendet und aufbewahrt werden.
Bei versehentlicher Einnahme ist unverzüglich ein Arzt zu Rate zu ziehen und die Packungsbeilage oder das Etikett vorzuzeigen.
Trächtigkeit und Laktation:
Die Unbedenklichkeit des Tierarzneimittels während der Trächtigkeit und Laktation bei Hündinnen ist nicht belegt. Nur anwenden nach entsprechender Nutzen-Risiko-Bewertung durch den behandelnden Tierarzt.
Laboruntersuchungen an Ratten und Kaninchen ergaben keine Hinweise auf teratogene oder fetotoxische Wirkungen. Allerdings ergaben diese Untersuchungen bei hohen Dosen Hinweise auf maternotoxische und embryotoxische Wirkungen. Ferner zeigten diese Untersuchungen, dass Pimobendan in die Milch übergeht.
Wechselwirkung mit anderen Arzneimitteln und sonstige Wechselwirkungen:
In pharmakologischen Studien wurde keine Wechselwirkung zwischen dem Herzglykosid Ouabain (Strophanthin) und Pimobendan beobachtet. Der durch Pimobendan induzierte Anstieg der kardialen Kontraktionskraft wird durch die Calciumantagonisten Verapamil und Diltiazem und den β-Rezeptor-Antagonisten Propranolol abgeschwächt.
Überdosierung:
Bei Überdosierung kann es zu einer positiv chronotropen Wirkung, Erbrechen, Apathie, Ataxie, Herzgeräuschen oder Hypotonie kommen. In diesem Fall ist die Dosis zu reduzieren und eine geeignete symptomatische Behandlung einzuleiten.
Bei längerer Exposition (6 Monate) gesunder Beagles gegenüber dem 3- bzw. 5-Fachen der empfohlenen Dosis wurden bei manchen Hunden eine Mitralklappenverdickung und eine linksventrikuläre Hypertrophie beobachtet. Diese Veränderungen sind pharmakodynamischen Ursprungs.
Wesentliche Inkompatibilitäten:
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Tierarzneimittel nicht mit anderen Tierarzneimitteln gemischt werden.
Nebenwirkungen
Hund:
Selten (1 bis 10 Tiere / 10 000 behandelte Tiere):
Erbrechen1, Durchfall2, Anorexie2, Lethargie2, Erhöhte Herzfrequenz1,3, Erhöhte Mitralklappenregurgitation4
Sehr selten (< 1 Tier / 10 000 behandelte Tiere, einschließlich Einzelfallberichte):
Schleimhautpetechien5, Blutung (subkutan)5
1. Diese Effekte sind dosisabhängig und können durch Reduzierung der Dosis vermieden werden.
2. Vorübergehend.
3. Aufgrund einer leicht positiven chronotropen Wirkung.
4. Beobachtet während Langzeitbehandlung mit Pimobendan bei Hunden mit Mitralklappenerkrankung.
5. Ein Zusammenhang mit Pimobendan konnte nicht eindeutig hergestellt werden, diese Symptome verschwinden nach Absetzen der Behandlung.
Die Meldung von Nebenwirkungen ist wichtig. Sie ermöglicht die kontinuierliche Überwachung der Verträglichkeit eines Tierarzneimittels. Falls Sie Nebenwirkungen, insbesondere solche, die nicht in der Packungsbeilage aufgeführt sind, bei Ihrem Tier feststellen, oder falls Sie vermuten, dass das Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte zuerst Ihrem Tierarzt mit. Sie können Nebenwirkungen auch an den Zulassungsinhaber oder seinen örtlichen Vertreter unter Verwendung der Kontaktdaten am Ende dieser Packungsbeilage oder über Ihr nationales Meldesystem melden.
AT: Bundesamt für Sicherheit im Gesundheitswesen,
Traisengasse 5, AT-1200 Wien
E-Mail: basg-v-phv@basg.gv.at,
Website: https://www.basg.gv.at/
DE: Die Meldungen sind vorzugsweise durch einen Tierarzt an das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) zu senden. Meldebögen und Kontaktdaten des BVL sind auf der Internetseite https://www.vet-uaw.de/ zu finden oder können per E-Mail (uaw@bvl.bund.de) angefordert werden. Für Tierärzte besteht die Möglichkeit der elektronischen Meldung auf der oben genannten Internetseite.
Dosierung für jede Tierart, Art und Dauer der Anwendung
Zum Eingeben.
Flasche vor oder während der Anwendung nicht schütteln, um Schaumbildung zu vermeiden.
Um eine korrekte Dosierung zu gewährleisten, sollte das Körpergewicht so genau wie möglich ermittelt werden.
Ein Dosierungsbereich von 0,2 mg bis 0,6 mg Pimobendan/kg Körpergewicht, verteilt auf zwei Dosen täglich, sollte eingehalten werden.
Die empfohlene Tagesdosis beträgt 0,5 mg Pimobendan/kg Körpergewicht, verteilt auf zwei Dosen täglich mit ungefähr 12 Stunden Abstand (d. h. 0,25 mg Pimobendan/kg Körpergewicht, entsprechend 0,17 ml des Tierarzneimittels zweimal täglich).
Die Lösung sollte mit der Dosierspritze verabreicht werden, die der Packung beiliegt.
Die Spritze verfügt über eine Skala nach kg Körpergewicht in 0,5-kg-Schritten bis zu einem Körpergewicht von 12 kg und passt auf die Flasche. Jeder 1-kg-Schritt entspricht 0,25 mg Pimobendan.
Für jede Verabreichung ist das Gesamtkörpergewicht des Tieres zur Dosierung zu berücksichtigen. Zum Beispiel soll für einen Hund mit einem Gewicht von 6 kg das Tierarzneimittel bei jeder Verabreichung bis zur 6-kg-Markierung auf der Spritze aufgezogen werden (dies entspricht einer Dosis von 0,25 mg Pimobendan/kg Körpergewicht pro Verabreichung). Die empfohlene Dosis soll nicht überschritten werden.
Jede Dosis sollte auf nüchternen Magen etwa eine Stunde vor dem Füttern direkt in das Maul verabreicht werden. Die Flasche nach der Verabreichung fest mit dem Verschluss verschließen. Reinigen Sie die Außenseite der Spritze nach jedem Gebrauch mit einem sauberen, trockenen Tuch oder Taschentuch. Das verunreinigte Taschentuch sollte sofort entsorgt werden.
Wenn die Spritze verstopft ist, spülen Sie sie mit Wasser aus, ohne den Kolben zu entfernen, und wischen Sie die Außenseite der Spritze mit einem sauberen Tuch oder Taschentuch trocken. Um eine Kontamination zu vermeiden, verwenden Sie die bereitgestellte Spritze nur zur Verabreichung von dieser Lösung zum Eingeben. Die gebrauchte Spritze ist zusammen mit dem Tierarzneimittel im Originalkarton aufzubewahren.
Pimobendan kann auch in Kombination mit einem Diuretikum, z. B. Furosemid, angewendet werden.
Hinweise für die richtige Anwendung
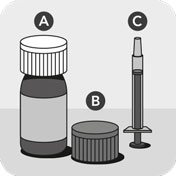
Das Tierarzneimittel besteht aus einer Flasche, die mit einem kindersicheren Verschluss A verschlossen ist, einem zweiten kindersicheren Verschluss mit integriertem Adapter B und einer Dosierspritze mit einer Skala nach kg Körpergewicht C.
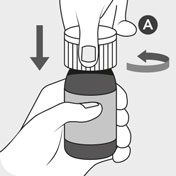
Flasche vor der Anwendung nicht schütteln (um Schaumbildung zu vermeiden). Die Flasche aufrecht halten und zum Öffnen den kindersicheren Verschluss A nach unten drücken und gleichzeitig gegen den Uhrzeigersinn drehen.
Den weißen Verschluss A entsorgen.
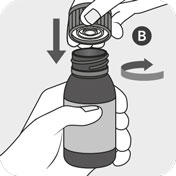
Die Flasche mit dem Verschluss B fest verschließen. Hierzu den Verschluss aufsetzen und im Uhrzeigersinn festdrehen. Der Verschluss B enthält einen integrierten Adapter, der automatisch an der Flasche A fixiert wird. Stellen Sie sicher, dass der Verschluss fest verschlossen ist, damit der Adapter richtig auf der Flasche sitzt.
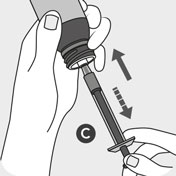
Nehmen Sie den Verschluss B ab, indem Sie den kindersicheren Verschluss nach unten drücken und ihn gleichzeitig gegen den Uhrzeigersinn drehen. Drücken Sie das Ende der Dosierspritze C vorsichtig auf den Flaschenstopfen.
Drehen Sie die Flasche mit der Spritze auf den Kopf. Ziehen Sie den Kolben nach unten und ziehen Sie die Dosierspritze bis zu der von Ihrem Tierarzt verschriebenen Dosis auf.
Drehen Sie die Flasche wieder um (aufrechte Position) und ziehen Sie die Dosierspritze aus der Flasche heraus. Verschließen Sie die Flasche mit dem Verschluss B.
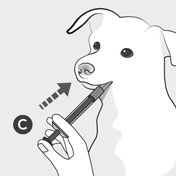
Führen Sie das Ende der Dosierspritze C in das Maul Ihres Hundes ein und drücken Sie den Kolben herunter, um die verschriebene Dosis zu verabreichen.
Die Informationen finden Sie auch unter folgendem Link: info.vetmedin.com/eu

Wartezeiten
Nicht zutreffend.
Besondere Lagerungshinweise
Außerhalb der Sicht und Reichweite von Kindern aufbewahren.
Unter 30 °C lagern.
Haltbarkeit nach dem ersten Öffnen/Anbruch der Primärverpackung: 8 Wochen.
Sie dürfen dieses Tierarzneimittel nach dem auf dem Umkarton und der Flasche angegebenen Verfalldatum nach „Exp.“ nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Besondere Vorsichtsmaßnahmen für die Entsorgung
AT: Arzneimittel sollten nicht über das Abwasser oder den Haushaltsabfall entsorgt werden.
Nutzen Sie Rücknahmesysteme für die Entsorgung nicht verwendeter Tierarzneimittel oder daraus entstandener Abfälle nach den örtlichen Vorschriften und die für das betreffende Tierarzneimittel geltenden nationalen Sammelsysteme.
DE: Nicht aufgebrauchte Tierarzneimittel sind vorzugsweise bei Schadstoffsammelstellen abzugeben. Bei gemeinsamer Entsorgung mit dem Hausmüll ist sicherzustellen, dass kein missbräuchlicher Zugriff auf diese Abfälle erfolgen kann. Tierarzneimittel dürfen nicht mit dem Abwasser bzw. über die Kanalisation entsorgt werden.
AT/DE: Diese Maßnahmen dienen dem Umweltschutz.
Fragen Sie Ihren Tierarzt oder Apotheker, wie nicht mehr benötigte Arzneimittel zu entsorgen sind.
Einstufung von Tierarzneimitteln
Tierarzneimittel, das der Verschreibungspflicht unterliegt.
Zulassungsnummern und Packungsgrößen
AT: Z.Nr.: 842739
DE: Z.Nr.: V7017737.00.00
Faltschachtel mit 1 Flasche befüllt mit 50 ml und 1 Dosierspritze mit einer Skala nach kg Körpergewicht in 0,5-kg-Schritten.
Datum der letzten Überarbeitung der Packungsbeilage
AT: 11/2025
DE: 11/2025
Detaillierte Angaben zu diesem Tierarzneimittel sind in der Produktdatenbank der Europäischen Union verfügbar (https://medicines.health.europa.eu/veterinary).
Kontaktdaten
AT:
Zulassungsinhaber:
Boehringer Ingelheim Vetmedica GmbH
Binger Str. 173
55216 Ingelheim, Deutschland
DE:
Zulassungsinhaber und Kontaktdaten zur Meldung vermuteter Nebenwirkungen:
Boehringer Ingelheim Vetmedica GmbH
Binger Str. 173
55216 Ingelheim, Deutschland
Tel: 0800 290 0 270
AT:
Örtlicher Vertreter und Kontaktdaten zur Meldung vermuteter Nebenwirkungen:
Boehringer Ingelheim RCV GmbH & Co KG
Dr. Boehringer Gasse 5-11
AT-1121 Wien
Tel: +43 1 80105-6880
Weitere Informationen
|
AT: Rezept- und apothekenpflichtig. DE: Verschreibungspflichtig. |
